VIDEO
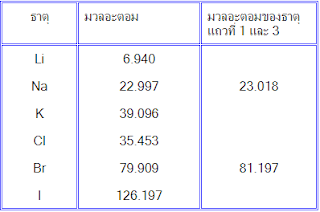
2.4.3 ขนาดอะตอม ขนาดอะตอมหาได้จากเทคนิคทาง x-ray diffraction และ microwave spectroscopy ถ้าอะตอมเรียงตัวอย่างมีระเบียบแบบชิดกันมากที่สุด ขนาดของอะตอมจะหาได้จากความสัมพันธ์ ดังนี้ ขนาดของ 1 อะตอม =
จากแบบจำลองอะตอมแบบกลุ่มหมอก อะตอมมีขอบเขตที่ไม่แน่นอน ระยะระหว่างนิวเคลียสถึงผิวอะตอมมีค่าไม่คงที่ ทำให้หาขนาดของอะตอมที่แท้จริงไม่ได้ จากแบบจำลองของอะตอมตามทฤษฎีของโบร์ อิเล็กตรอนในไฮโดรเจนอะตอมอาจมีพลังงานได้หลายค่า ขนาดอะตอมของไฮโดรเจนจึงขึ้นอยู่กับว่าอิเล็กตรอนอยู่ในระดับพลังงานใด ถ้าอยู่ในระดับพลังงานสูง จะอยู่ห่างจากนิวเคลียสมาก ขนาดอะตอมจะใหญ่ และถ้าอยู่ในระดับพลังงานต่ำ จะอยู่ใกล้นิวเคลียส ขนาดอะตอมจะเล็ก ดังนั้นจึงทำให้หาขนาดของอะตอมที่แท้จริงไม่ได้
2.4.4 ขนาดไอออน อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอน เมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออน นักเรียนคิดว่าขนาดของไอออนกับขนาดอะตอมของธาตุเดียวกันจะแตกต่างกันหรือไม่การบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม กล่าวคือจะบอกเป็นค่ารัศมีไอออน ซึ่งพิจารณาจากระยะระหว่างนิวเคลียสของไอออนคู่หนึ่งๆ ที่มีแรงยึดเหนี่ยวซึ่งกันและกันในโครงผนึก ตัวอย่างรัศมีไอออนของ และ ในสารประกอบ MgO แสดงดังรูป
- ขนาดของ Mg กับ
และ O กับ
แตกต่างกันอย่างไร เพราะเหตุใด
เมื่อโลหะทำปฏิกิริยากับอโลหะ อะตอมของโลหะจะเสียเวเลนซ์อิเล็กตรอนกลายเป็นไอออนบวก จำนวนอิเล็กตรอนในอะตอมจึงลดลง ทำให้แรงผลักระหว่างอิเล็กตรอนลดลงด้วย หรือกล่าวอีกนัยหนึ่งได้ว่าแรงดึงดูดระหว่างประจุในนิวเคลียสกับอิเล็กตรอนจะเพิ่มมากขึ้นไอออนบวกจึงมีขนาดเล็กกว่าอะตอมเดิม ส่วนอะตอมของอโลหะนั้นส่วนใหญ่จะรับอิเล็กตรอนเพิ่มเข้ามาและเกิดเป็นไอออนลบ เนื่องจากมีการเพิ่มขึ้นของจำนวนอิเล็กตรอนจึงทำให้แรงผลักระหว่างอิเล็กตรอนที่เคลื่อนที่อยู่รอบนิวเคลียสมีค่าสูงขึ้น ขอบเขตของกลุ่มหมอกอิเล็กตรอนจะขยายออกไปจากเดิม ไอออนลบจึงมีมีขนาดใหญ่กว่าอะตอมเดิม ตัวอย่างขนาดอะตอมกับขนาดไอออนของธาตุแสดงดังรูป
รัศมีอะตอมและรัศมีไอออน (พิโกเมตร) ของธาตุบางชนิด
- ขนาดไอออนตามหมู่มีแนวโน้มอย่างไร
-
กับ
มีการจัดอิเล็กตรอนและขนาดไอออนแตกต่างกันหรือไม่ อย่างไร
-
และ
มีขนาดไอออนแตกต่างกันอย่างไร
จากรูป เมื่อพิจารณาแนวโน้มของรัศมีอะตอมและรัศมีไอออนตามหมู่ จะพบว่าหมู่ IA IIA IIIA และ VIIA มีแนวโน้มเช่นเดียวกันคืออะตอมและไอออนมีขนาดเพิ่มขึ้นจากบนลงล่าง รัศมีไอออนบวกจะมีค่าน้อยกว่ารัศมีอะตอมแต่รัศมีไอออนลบจะมีค่ามากกว่ารัศมีอะตอมการเปรียบเทียบขนาดไอออนที่มีความหมาย จะเปรียบเทียบระหว่างไอออนที่มีการจัดอิเล็กตรอนเหมือนกันหรือมีจำนวนอิเล็กตรอนเท่ากัน เช่น
กับ
ซึ่งมี 10 อิเล็กตรอนเท่ากันและจัดอิเล็กตรอนเป็น พบว่า
มีขนาดไอออนเล็กกว่า
ทั้งนี้เพราะ
มีประจุในนิวเคลียสมากกว่า
ส่วนไอออนบวกที่จัดอิเล็กตรอนเหมือนกัน ไอออนบวกที่มีประจุมากจะมีขนาดเล็กกว่าไอออนบวกที่มีประจุน้อย นั่นคือไอออน 3+ จะมีขนาดเล็กกว่า 2+ และ 1+ ตามลำดับ
2.4.5 พลังงานไอออไนเซซัน
พลังงานไอออไนเซชัน (ionization energy : IE) หมายถึงพลังงานที่น้อยที่สุดที่ใช้เพื่อทำให้อิเล็กตรอนหลุดออกจากอะตอมในสถานะแก๊สกลายเป็นไอออนในสถานะแก๊ส เช่น การทำให้โฮโดรเจนอะตอมกลายเป็นไฮโดรเจนไอออนในสถานะแก๊ส เขียนแสดงได้ดังนี้
H(g) --------------> H+(g) + e– IE = 1318 kJ/mol
ไฮโดรเจนมีเพียง 1 อิเล็กตรอน จึงมีค่าพลังงานไอออไนเซชันเพียงค่าเดียว ถ้าเป็นธาตุที่มีหลายอิเล็กตรอนก็จะมรพลังงานไอออไนเซชันหลายค่า พลังงานน้อยที่สุดที่ทำให้อิเล็กตรอนตัวแรกหลุดออกตากอะตอมในสถานะแก๊สเรียกว่า “พลังงานไอออไนเซชันลำดับที่ 1” เขียนย่อเป็น IE1พลังงานที่ทำให้อิเล็กตรอนตัวต่อ ๆ ไปหลุดออกจากอะตอมในสถานะแก๊สก็จะเรียกว่า พลังงานไอออไนเซชันลำดับที่ 2 , 3 , . . . ตามลำดับ และเขียนย่อเป็น IE2 , IE3 , . . . ตามลำดับ เช่น ธาตุโบรอนมี 5 อิเล็กตรอน ก็จะมีพลังงานไอออไนเซชัน 5 ค่า ดังนี้
B(g) ---------> B+(g) + e– IE1 = 807 kJ/mol
B+(g) --------> B2+(g) + e– IE2 = 2433 kJ/mol
B2+ (g) --------> B3+ (g) + e– IE3 = 3666 kJ/mol
B3+ (g) -----------> B4+ (g) + e– IE4 = 25033 kJ/mol
B4+ (g) ---------> B5+ (g) + e– IE5 = 32834 kJ/mol
พลังงานไอออไนเซชันกับจำนวนอิเล็กตรอนในระดับพลังงาน
ค่าพลังงานไอออไนเซชันของธาตุต่าง ๆ ในตารางธาตุใช้เป็นข้อมูลในการจัดกลุ่มอิเล็กตรอนที่อยู่รอบนิวเคลียส ซึ่งพบความสัมพันธ์คือ อิเล็กตรอนที่อยู่ในระดับพลังงานเดียวกัน (ชั้นเดียวกัน) จะมีค่าพลังงานไอออไนเซชันใกล้เคียงกัน และอิเล็กตรอนที่อยู่ต่างระดับพลังงานกัน จะมีค่าพลังงานไอออไนเซชันแตกต่างกันมาก ซึ่งสรุปความสัมพันธ์ถึงจำนวนอิเล็กตรอนในแต่ละระดับพลังงานจะมีจำนวนไม่เกิน 2n2
สรุปแนวโน้มพลังงานไอออไนเซชัน
1. แนวโน้มค่าพลังงานไอออไนเซชันลำดับที่ 1 ( IE1) ตามคาบ พบว่ามีแนวโน้มเพิ่มขึ้นตามเลขอะตอม เนื่องจากธาตุในคาบเดียวกันมีจำนวนโปรตอนในนิวเคลียสเพิ่มขึ้นและมีขนาดอะตอมเล็กลง แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนจึงเพิ่มมากขึ้น อิเล็กตรอนจึงหลุดออกจากอะตอมได้ยาก
2. แนวโน้มค่าพลังงานไอออไนเซชันลำดับที่ 1 ( IE1) ตามหมู่ ปัจจัยทีมีผลคือคือขนาดอะตอมซึ่งเป็นผลมาจากระดับพลังงาน ค่า IE1จะลดลงเมื่ออะตอมมีขนาดใหญ่ขึ้น เพราะขนาดอะตอมที่ใหญ่ขึ้นจะมีเวเลนซ์อิเล็กตรอนที่ห่างนิวเคลียสมากขึ้น อิเล็กตรอนจะได้รับแรงดึงดูดจากนิวเคลียสน้อย อิเล็กตรอนจะหลุดออกจากอะตอมได้ง่าย
2.4.6 สัมพรรคภาคอิเล็กตรอน
สัมพรรคภาพอิเล็กตรอน (electron affinity) คือ พลังงานที่อะตอมในสถานะแก๊สคายออกมาเมื่อได้รับอิเล็กตรอน
F(g) + e- สรุปแนวโน้มสัมพรรคภาพอิเล็กตรอน
1. เมื่อพิจารณาตามคาบ ค่า EA ในหมู่ IA IIA และ IIIA มีค่าเป็นลบน้อยกว่าธาตุที่อยู่ทางขวามือ แสดงว่าธาตุในหมู่ดังกล่าวมีแนวโน้มที่จะรับอิเล็กตรอนได้น้อยมาก โดยเฉพาะธาตุในหมู่ IIA มีค่า EA สูงที่สุด แสดงว่ารับอิเล็กตรอนยากที่สุด
2. ธาตุหมู่ IVA VA VIA และ VIIA มีแนวโน้มสูงที่จะรับอิเล็กตรอน โดยเฉพาะธาตุหมู่ VIIA ชอบที่จะรับอิเล็กตรอนสูงที่สุด การรับอิเล็กตรอนของธาตุในหมู่ VIIA จะทำให้อะตอมมีการจัดเรียงอิเล็กตรอนเหมือนแก๊สเฉื่อยซึ่งมีความเสถียรมาก EA ของแก๊สเฉื่อยจึงมีค่าเป็นบวก
2.4.7 อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตี (electronegativity : EN) หมายถึงค่าที่แสดงความสามารถในการดึงดูดอิเล็กตรอนของอะตอมคู่ที่เกิดพันธะที่จะรวมกันเป็นโมเลกุล ธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูงจะมีความสามารถในการดึงดูดหรือรับอิเล็กตรอนได้ดี ได้แก่พวกอโลหะ ส่วนธาตุที่มีค่าอิเล็กโทรเนกาติวิตีต่ำจะดึงดูดหรือรับอิเล็กตรอนได้ไม่ดี ได้แก่พวกโลหะ เช่น โมเลกุลของ HCl เนื่องจาก Cl ดึงดูดอิเล็กตรอนได้ดีกว่า H ดังนั้น Cl จึงมีค่าอิเล็กโทรเนกาติวิตีสูงกว่า H
สรุปแนวโน้มค่าอิเล็กโทรเนกาติวิตี
1. แนวโน้มค่าอิเล็กโทรเนกาติวิตีตามคาบ
ปัจจัยที่มีผลคือเลขอะตอมหรือประจุบวกในนิวเคลียส ธาตุที่มีประจุบวกในนิวเคลียสมากจะมีค่า EN สูง ดังนั้นธาตุที่อยู่ในคาบเดียวกันจะมีค่า EN ดังนั้นธาตุที่อยู่ในคาบเดียวกันจะมีค่า EN เพิ่มขึ้นจากซ้ายไปขวา เพราะประจุบวกที่นิวเคลียสจะส่งแรงดึงดูดกระทำต่ออิเล็กตรอนได้มาก
2. แนวโน้มค่าอิเล็กโทรเนกาติวิตีตามหมู่
ปัจจัยที่มีผลคือขนาดอะตอมซึ่งเป็นผลมาจากจำนวนระดับพลังงาน ธาตุที่มีจำนวนระดับพลังงานน้อย หรือขนาดอะตอมเล็ก จะมีค่า EN สูงกว่าธาตุที่มีขนาดอะตอมใหญ่ในหมู่เดียวกัน เพราะอะตอมที่มีขนาดใหญ่นิวเคลียสจะส่งแรงดึงดูดออกไปที่เวเลนซ์อิเล็กตรอนได้น้อย ดังนั้น “ธาตุที่อยู่ในหมู่เดียวกันจะมีค่า EN ลดลงจากบนลงล่าง”
2.5 ธาตุทรานซิซัน 2.5.1 สมบัติของธาตุแทรนซิชัน นักเคมีจัดธาตุแทรนซิชันไว้ในกลุ่มของธาตุที่เป็นโลหะ แต่ไม่ได้เป็นกลุ่มเดียวกับธาตุหมู่ IA IIA และ IIIA เพราะเหตุใดจึงจัดธาตุแทรนซิชันไว้อีกกลุ่มหนึ่ง เพื่อตอบคำถามนี้ให้ศึกษาสมบัติของธาตุแทรนซิชันเปรียบเทียบกับสมบัติของธาตุหมู่ IA และ IIA ที่อยู่ในคาบเดียวกันจากตาราง
สมบัติบางประการของโพแทสเซียม แคลเซียม และธาตุแทรนซิชันในคาบที่ 4
- ธาตุแทรนซิชันในคาบที่ 4 กับโลหะโพแทสเซียมและแคลเซียม มีสมบัติใดคล้ายกันและสมบัติใดแตกต่างกัน จากตาราง 3.5 พบว่าธาตุแทรนซิชันในคาบที่ 4 มีสมบัติหลายประการคล้ายกับโลหะโพแทสเซียมและแคลเซียม เช่น พลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโทรเนกาติวิตีมีค่าต่ำ แต่จุดหลอมเหลว จุดเดือด และความหนาแน่นมีค่าสูง และสูงมากกว่าหมู่ IA และหมู่ IIA ธาตุเทรนซิชัน จึงควรเป็นโลหะ แต่ธาตุแทรนซิชันในคาบที่ 4 มีสมบัติบางประการที่แตกต่างจากโลหะโพแทสเซียมและแคลเซียมคือ มีขนาดอะตอมใกล้เคียงกันภายในกลุ่มของธาตุแทรนซิชันเอง แต่มีขนาดเล็กกว่าโลหะโพแทสเซียมและแคลเซียม นักเรียนคิดว่าเพราะเหตุใดจึงเป็นเช่นนั้น ให้พิจารณาการจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียมแคลเซียมและธาตุแทรนซิชันในคาบที่ 4
การจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียม แคลเซียม และธาตุแทรนซิชันในคาบที่ 4
2.6 ธาตุกัมมันตรังสี
ธาตุกัมมันตรังสี หมายถึงธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียร เป็นธาตุที่มีเลขอะตอมสูงกว่า 82
ในนิวเคลียสของธาตุประกอบด้วยโปรตอนซึ่ง มีประจุบวกและนิวตรอนซึ่งเป็นกลางทางไฟฟ้า สัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร ธาตุนั้นจึงปล่อยรังสีออกมาเพื่อปรับตัวเองให้เสถียร ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ เช่น
(ธาตุยูเรเนียม) (ธาตุทอเลียม) (อนุภาคแอลฟา)
จะเห็นได้ว่า การแผ่รังสีจะทำให้เกิดธาตุใหม่ได้ หรืออาจเป็นธาตุเดิมแต่จำนวนโปรตอนหรือนิวตรอนอาจไม่เท่ากับธาตุเดิม และธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาในการสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกัน เรียกว่า ครึ่งชีวิตของธาตุ
กัมมันตภาพรังสี (Radioactivity) เป็นคุณสมบัติของธาตุและไอโซโทปบางส่วน ที่สามารถเปลี่ยนแปลงตัวเองเป็นธาตุหรือไอโซโทปอื่น ซึ่งการเปลี่ยนแปลงนี้จะมีการปลดปล่อยหรือส่งรังสีออกมาด้วย ปรากฏการณ์นี้ได้พบครั้งแรกโดย เบคเคอเรล เมื่อปี พ.ศ. 2439 ต่อ มาได้มีการพิสูจน์ทราบว่า รังสีที่แผ่ออกมาในขบวนการสลายตัวของธาตุหรือไอโซโทปนั้นประกอบด้วย รังสีแอลฟา, รังสีเบต้า และรังสีแกมมา
รังสีแอลฟา
การสลายตัวให้รังสีแอลฟา
รังสีเบต้า
การสลายตัวให้รังสีบีตา
รังสีแกมมา
การสลายตัวให้รังสีแกมมา
การสลายตัวของธาตุกัมมันตรังสี
การที่ธาตุกัมมันตรังสีแผ่รังสีได้นั้นเป็นเพราะนิวเคลียสของธาตุไม่เสถียร เนื่องจากมีพลังงานส่วนเกินอยู่ภายใน ดังนั้นจึงจำเป็นต้องถ่ายเทพพลังงานส่วนเกินนี้ออกไป เพื่อให้นิวเคลียสเสถียรในที่สุด พลังงานส่วนเกินที่ปล่อยออกมาอยู่ในรูปของอนุภาคหรือรังสีต่าง ๆ เช่น อนุภาคแอลฟา อนุภาคบีตา รังสีแกมมาและไอโชโทปที่เสถียร จากการศึกษาไอโชโทปของธาตุจำนวนมาก พบว่าไอโชโทปที่นิวเคลียสมีอัตราส่วนระหว่าจำนวนนิวตรอนต่อโปรตอนไม่เหมาะสม คือนิวเคลียสที่มีจำนวนนิวตรอนมาก หรือ น้อยกว่าจำนวนโปรตอนมักจะไม่เสถียรจะมีการแผ่รังสีออกมาจนได้ไอโชโทปของธาตุใหม่ที่เสถียรกว่า นอกจากนั้นยังพบว่าจำนวนโปรตอนและนิวตรอนที่เป็นจำนวนคู่ หรือคี่ในนิวเคลียสนั้น มีความสัมพันธ์กับความเสถียรภาพของนิวเคลียสด้วย กล่าวคือ ไอโชโทปของธาตุที่มีจำนวนโปรตอน และนิวตรอนเป็นเลขคู่ จะเสถียรกว่าไอโชโทปของธาตุที่มีจำนวนโปรตอนและนิวตอนเป็นเลขคี่เช่น 714N เป็นไอโซโทปที่เสถียร 715N พบว่า 714N มีจำนวนโปรตอนและจำนวนนิวตรอน จึงเสถียรกว่า 715Nที่มีจำนวนโปรตอนไม่เท่ากับจำนวนนิวตรอน816O เป็นไอโซโทปที่เสถียรกว่า817O เพราะ 816O มีจำนวนโปรตอนและจำนวนนิวตรอนเท่ากัน จึงเสถียรกว่า817O ที่มีจำนวนนิวตรอนเป็นเลขคี่ และจำนวนโปรตอนเป็นเลขคู่
ครึ่งชีวิตของธาตุกัมมันตรังสี
ครึ่งชีวิตของธาตุ (half life) หมายถึง ระยะเวลาที่สารสลายตัวไปจนเหลือเพียงครึ่งหนึ่งของปริมาณเดิมใช้สัญลักษณ์เป็น t1/2 นิวเคลียสของธาตุกัมมันตรังสีที่ไม่เสถียร จะสลายตัวและแผ่รังสีได้เองตลอดเวลาโดยไม่ขึ้นอยู่กับอุณหภูมิหรือความดัน อัตราการสลายตัว เป็นสัดส่วนโดยตรงกับจำนวนอนุภาคในธาตุกัมมันตรังสีนั้น ปริมาณการสลายตัวจะบอกเป็นครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ตัวอย่างเช่น C-14 มีครึ่งชีวิต 5730 ปี หมายความว่า ถ้ามี C-14 1 กรัม เมื่อเวลาผ่านไป 5730 ปี จะเหลือ C-14 อยู่ 0.5 กรัม และเมื่อเวลาผ่านไปอีก 5730 ปี จะเหลืออยู่ 0.25 กรัม เป็นดังนี้ไปเรื่อยๆ กล่าวได้ว่าทุกๆ 5730 ปี จะเหลือ C-14 เพียงครึ่งหนึ่งของปริมาณเดิม
ครึ่งชีวิต (half life) ของสารกัมมันตรังสี สามารถนำไปใช้หาอายุอายุสัมบูรณ์ (Absolute Age) เป็นอายุของหินหรือซากดึกดำบรรพ์ ที่สามารถบอกจำนวนปีที่ค่อนข้างแน่นอน การหาอายุสัมบูรณ์ใช้วิธีคำนวณจากครึ่งชีวิต ของธาตุกัมมันตรังสีที่มีอยู่ในหิน หรือซากดึกดำบรรพ์ที่ต้องการศึกษา ธาตุกัมมันตรังสีที่นิยมนำมาหาอายุสัมบูรณ์ได้แก่ ธาตุคาร์บอน – 14 ธาตุโพแทศเซียม – 40 ธตาเรเดียม – 226 และธาตุยูเรเนียม – 238 เป็นต้น การหาอายุสัมบูรณ์มักใช้กับหินที่มีอายุมากเป็นแสนล้านปี เช่น หินแกรนิตบริเวณฝั่งตะวันตกของเกาะภูเก็ต ซึ่งเคยเป็นหินต้นกำเนิดแร่ดีบุกมีอายุสัมบูรณ์ประมาณ 100 ล้านปี ส่วนตะกอนและซากดึกดำบรรพ์ที่มีอายุน้อยกว่า 50,000 ปี มักจะใช้วิธีกัมมันตภาพรังสีคาร์บอน – 14 เช่น ซากหอยนางรมที่วัดเจดีย์หอย อำเภอลาดหลุมแก้ว จังหวัดปทุมธานี มีอายุประมาณ 5,500 ปีของวัตถุโบราณ
ประโยชน์ของครึ่งชีวิต
ครึ่งชีวิตสามารถใช้หาอายุของวัตถุโบราณที่มีธาตุคาร์บอนเป็นองค์ประกอบ เรียกว่าวิธี Radiocarbon Dating ซึ่งคำว่า dating หมายถึง การหาอายุจึงมักใช้หาอายุของวัตถุโบราณที่มีคุณค่าทางประวิติศาสตร์
หลักการสำคัญของการหาอายุวัตถุโบราณโดยวิธี Radiocarbon Dating เป็นหลักการที่อาศัยความรู้เกี่ยวกับกัมมันตภาพรังสีที่เกิดขึ้นเองในอากาศ ตัวการที่สำคัญคือ รังสีคอสมิก ซึงอยู่ในบรรยากาศเหนือพื้นโลก มีความเข้มสูงจนทำให้นิวเคลียสขององค์ประกอบของอากาศแตกตัวออก ให้อนุภาคนิวตรอน แล้วอนุภาคนิวตรอนชนกับไนโตรเจนในอากาศ
ตารางครึ่งชีวิตของธาตุกัมมันตรังสีบางชนิด
ตารางที่ 1 แสดงครึ่งชีวิตของธาตุกัมมันตรังสีบางธาตุและชนิดของการสลายตัว
ข้อควรจำ
1. ในทางปฏิบัติการวัดหาจำนวนนิวเคลียสโดยตรงกระทำได้ยาก และเนื่องจากจำนวนนิวเคลียสในสารหนึ่ง ๆ จะเป็นสัดส่วนกับปริมาณของสารนั้น ๆ ดังนั้นจึงพิจารณาเป็นค่ากัมมันตภาพหรืการวัดมวลแทน ดังนี้
โดยที่ A0 คือกัมมันตภาพที่เวลาเริ่มต้น (t=0)
โดยที่ m0 คือมวลสารตั้งต้นที่เวลาเริ่มต้น (t=0)
ประโยชน์และโทษของธาตุกัมมันตรังสี
ในทางอุตสาหกรรม ใช้รังสีวัดวามหนาของวัสดุในโรงงานผลิตกระดาษ ผลิตแผ่นยาง และแผ่นโลหะ ใช้รังสีในการวิเคราะห์ส่วนประกอบของผลิตภัณฑ์ เช่น โลหะผสม แร่ ถ่านหิน และตรวจสอบรอยเชื่อม–รอนร้าวในโลหะหรือโครงสร้างอาคาร ใช้ยูเรเนียมเป็นเชื้อเพลิงสำหรับผลิตกระแสไฟฟ้าในโรงไฟฟ้านิวเคลียร์
ทางการเกษตร ใช้รังสีในการถนอมอาหารเพื่อยืดอายุการเก็บรักษาอาหาร เพราะรังสีจะทำลายแบคทีเรียและจุลินทรีย์ที่ก่อให้เกิดการเน่าเสียในอาหาร ใช้รังสีเพื่อปรับปรุงพันธุ์พืชให้มีความแข็งแรงต้านทานต่อโรคและแมลง เพื่อเพิ่มผลผลิตให้สูงขึ้นครึ่งชีวิตของธาตุกัมมันตรังสี
ครึ่งชีวิตของธาตุ (half life) หมายถึง ระยะเวลาที่สารสลายตัวไปจนเหลือเพียงครึ่งหนึ่งของปริมาณเดิมใช้สัญลักษณ์เป็น t1/2 นิวเคลียสของธาตุกัมมันตรังสีที่ไม่เสถียร จะสลายตัวและแผ่รังสีได้เองตลอดเวลาโดยไม่ขึ้นอยู่กับอุณหภูมิหรือความดัน อัตราการสลายตัว เป็นสัดส่วนโดยตรงกับจำนวนอนุภาคในธาตุกัมมันตรังสีนั้น ปริมาณการสลายตัวจะบอกเป็นครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ตัวอย่างเช่น C-14 มีครึ่งชีวิต 5730 ปี หมายความว่า ถ้ามี C-14 1 กรัม เมื่อเวลาผ่านไป 5730 ปี จะเหลือ C-14 อยู่ 0.5 กรัม และเมื่อเวลาผ่านไปอีก 5730 ปี จะเหลืออยู่ 0.25 กรัม เป็นดังนี้ไปเรื่อยๆ กล่าวได้ว่าทุกๆ 5730 ปี จะเหลือ C-14 เพียงครึ่งหนึ่งของปริมาณเดิม
ครึ่งชีวิต (half life) ของสารกัมมันตรังสี สามารถนำไปใช้หาอายุอายุสัมบูรณ์ (Absolute Age) เป็นอายุของหินหรือซากดึกดำบรรพ์ ที่สามารถบอกจำนวนปีที่ค่อนข้างแน่นอน การหาอายุสัมบูรณ์ใช้วิธีคำนวณจากครึ่งชีวิต ของธาตุกัมมันตรังสีที่มีอยู่ในหิน หรือซากดึกดำบรรพ์ที่ต้องการศึกษา ธาตุกัมมันตรังสีที่นิยมนำมาหาอายุสัมบูรณ์ได้แก่ ธาตุคาร์บอน – 14 ธาตุโพแทศเซียม – 40 ธตาเรเดียม – 226 และธาตุยูเรเนียม – 238 เป็นต้น การหาอายุสัมบูรณ์มักใช้กับหินที่มีอายุมากเป็นแสนล้านปี เช่น หินแกรนิตบริเวณฝั่งตะวันตกของเกาะภูเก็ต ซึ่งเคยเป็นหินต้นกำเนิดแร่ดีบุกมีอายุสัมบูรณ์ประมาณ 100 ล้านปี ส่วนตะกอนและซากดึกดำบรรพ์ที่มีอายุน้อยกว่า 50,000 ปี มักจะใช้วิธีกัมมันตภาพรังสีคาร์บอน – 14 เช่น ซากหอยนางรมที่วัดเจดีย์หอย อำเภอลาดหลุมแก้ว จังหวัดปทุมธานี มีอายุประมาณ 5,500 ปีของวัตถุโบราณ
ประโยชน์ของครึ่งชีวิต
ครึ่งชีวิตสามารถใช้หาอายุของวัตถุโบราณที่มีธาตุคาร์บอนเป็นองค์ประกอบ เรียกว่าวิธี Radiocarbon Dating ซึ่งคำว่า dating หมายถึง การหาอายุจึงมักใช้หาอายุของวัตถุโบราณที่มีคุณค่าทางประวิติศาสตร์
หลักการสำคัญของการหาอายุวัตถุโบราณโดยวิธี Radiocarbon Dating เป็นหลักการที่อาศัยความรู้เกี่ยวกับกัมมันตภาพรังสีที่เกิดขึ้นเองในอากาศ ตัวการที่สำคัญคือ รังสีคอสมิก ซึงอยู่ในบรรยากาศเหนือพื้นโลก มีความเข้มสูงจนทำให้นิวเคลียสขององค์ประกอบของอากาศแตกตัวออก ให้อนุภาคนิวตรอน แล้วอนุภาคนิวตรอนชนกับไนโตรเจนในอากาศ
ตารางครึ่งชีวิตของธาตุกัมมันตรังสีบางชนิด
ตารางที่ 1 แสดงครึ่งชีวิตของธาตุกัมมันตรังสีบางธาตุและชนิดของการสลายตัว
ข้อควรจำ
1. ในทางปฏิบัติการวัดหาจำนวนนิวเคลียสโดยตรงกระทำได้ยาก และเนื่องจากจำนวนนิวเคลียสในสารหนึ่ง ๆ จะเป็นสัดส่วนกับปริมาณของสารนั้น ๆ ดังนั้นจึงพิจารณาเป็นค่ากัมมันตภาพหรืการวัดมวลแทน ดังนี้
โดยที่ A0 คือกัมมันตภาพที่เวลาเริ่มต้น (t=0)
โดยที่ m0 คือมวลสารตั้งต้นที่เวลาเริ่มต้น (t=0)
ประโยชน์และโทษของธาตุกัมมันตรังสี
ในทางอุตสาหกรรม ใช้รังสีวัดวามหนาของวัสดุในโรงงานผลิตกระดาษ ผลิตแผ่นยาง และแผ่นโลหะ ใช้รังสีในการวิเคราะห์ส่วนประกอบของผลิตภัณฑ์ เช่น โลหะผสม แร่ ถ่านหิน และตรวจสอบรอยเชื่อม–รอนร้าวในโลหะหรือโครงสร้างอาคาร ใช้ยูเรเนียมเป็นเชื้อเพลิงสำหรับผลิตกระแสไฟฟ้าในโรงไฟฟ้านิวเคลียร์
ทางการเกษตร ใช้รังสีในการถนอมอาหารเพื่อยืดอายุการเก็บรักษาอาหาร เพราะรังสีจะทำลายแบคทีเรียและจุลินทรีย์ที่ก่อให้เกิดการเน่าเสียในอาหาร ใช้รังสีเพื่อปรับปรุงพันธุ์พืชให้มีความแข็งแรงต้านทานต่อโรคและแมลง เพื่อเพิ่มผลผลิตให้สูงขึ้นครึ่งชีวิตของธาตุกัมมันตรังสี
ครึ่งชีวิตของธาตุ (half life) หมายถึง ระยะเวลาที่สารสลายตัวไปจนเหลือเพียงครึ่งหนึ่งของปริมาณเดิมใช้สัญลักษณ์เป็น t1/2 นิวเคลียสของธาตุกัมมันตรังสีที่ไม่เสถียร จะสลายตัวและแผ่รังสีได้เองตลอดเวลาโดยไม่ขึ้นอยู่กับอุณหภูมิหรือความดัน อัตราการสลายตัว เป็นสัดส่วนโดยตรงกับจำนวนอนุภาคในธาตุกัมมันตรังสีนั้น ปริมาณการสลายตัวจะบอกเป็นครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ตัวอย่างเช่น C-14 มีครึ่งชีวิต 5730 ปี หมายความว่า ถ้ามี C-14 1 กรัม เมื่อเวลาผ่านไป 5730 ปี จะเหลือ C-14 อยู่ 0.5 กรัม และเมื่อเวลาผ่านไปอีก 5730 ปี จะเหลืออยู่ 0.25 กรัม เป็นดังนี้ไปเรื่อยๆ กล่าวได้ว่าทุกๆ 5730 ปี จะเหลือ C-14 เพียงครึ่งหนึ่งของปริมาณเดิม
ครึ่งชีวิต (half life) ของสารกัมมันตรังสี สามารถนำไปใช้หาอายุอายุสัมบูรณ์ (Absolute Age) เป็นอายุของหินหรือซากดึกดำบรรพ์ ที่สามารถบอกจำนวนปีที่ค่อนข้างแน่นอน การหาอายุสัมบูรณ์ใช้วิธีคำนวณจากครึ่งชีวิต ของธาตุกัมมันตรังสีที่มีอยู่ในหิน หรือซากดึกดำบรรพ์ที่ต้องการศึกษา ธาตุกัมมันตรังสีที่นิยมนำมาหาอายุสัมบูรณ์ได้แก่ ธาตุคาร์บอน – 14 ธาตุโพแทศเซียม – 40 ธตาเรเดียม – 226 และธาตุยูเรเนียม – 238 เป็นต้น การหาอายุสัมบูรณ์มักใช้กับหินที่มีอายุมากเป็นแสนล้านปี เช่น หินแกรนิตบริเวณฝั่งตะวันตกของเกาะภูเก็ต ซึ่งเคยเป็นหินต้นกำเนิดแร่ดีบุกมีอายุสัมบูรณ์ประมาณ 100 ล้านปี ส่วนตะกอนและซากดึกดำบรรพ์ที่มีอายุน้อยกว่า 50,000 ปี มักจะใช้วิธีกัมมันตภาพรังสีคาร์บอน – 14 เช่น ซากหอยนางรมที่วัดเจดีย์หอย อำเภอลาดหลุมแก้ว จังหวัดปทุมธานี มีอายุประมาณ 5,500 ปีของวัตถุโบราณ
ประโยชน์ของครึ่งชีวิต
ครึ่งชีวิตสามารถใช้หาอายุของวัตถุโบราณที่มีธาตุคาร์บอนเป็นองค์ประกอบ เรียกว่าวิธี Radiocarbon Dating ซึ่งคำว่า dating หมายถึง การหาอายุจึงมักใช้หาอายุของวัตถุโบราณที่มีคุณค่าทางประวิติศาสตร์
หลักการสำคัญของการหาอายุวัตถุโบราณโดยวิธี Radiocarbon Dating เป็นหลักการที่อาศัยความรู้เกี่ยวกับกัมมันตภาพรังสีที่เกิดขึ้นเองในอากาศ ตัวการที่สำคัญคือ รังสีคอสมิก ซึงอยู่ในบรรยากาศเหนือพื้นโลก มีความเข้มสูงจนทำให้นิวเคลียสขององค์ประกอบของอากาศแตกตัวออก ให้อนุภาคนิวตรอน แล้วอนุภาคนิวตรอนชนกับไนโตรเจนในอากาศ
ตารางครึ่งชีวิตของธาตุกัมมันตรังสีบางชนิด
ตารางที่ 1 แสดงครึ่งชีวิตของธาตุกัมมันตรังสีบางธาตุและชนิดของการสลายตัว
ข้อควรจำ
1. ในทางปฏิบัติการวัดหาจำนวนนิวเคลียสโดยตรงกระทำได้ยาก และเนื่องจากจำนวนนิวเคลียสในสารหนึ่ง ๆ จะเป็นสัดส่วนกับปริมาณของสารนั้น ๆ ดังนั้นจึงพิจารณาเป็นค่ากัมมันตภาพหรืการวัดมวลแทน ดังนี้
โดยที่ A0 คือกัมมันตภาพที่เวลาเริ่มต้น (t=0)
โดยที่ m0 คือมวลสารตั้งต้นที่เวลาเริ่มต้น (t=0)
ประโยชน์และโทษของธาตุกัมมันตรังสี
ในทางอุตสาหกรรม ใช้รังสีวัดวามหนาของวัสดุในโรงงานผลิตกระดาษ ผลิตแผ่นยาง และแผ่นโลหะ ใช้รังสีในการวิเคราะห์ส่วนประกอบของผลิตภัณฑ์ เช่น โลหะผสม แร่ ถ่านหิน และตรวจสอบรอยเชื่อม–รอนร้าวในโลหะหรือโครงสร้างอาคาร ใช้ยูเรเนียมเป็นเชื้อเพลิงสำหรับผลิตกระแสไฟฟ้าในโรงไฟฟ้านิวเคลียร์
ทางการเกษตร ใช้รังสีในการถนอมอาหารเพื่อยืดอายุการเก็บรักษาอาหาร เพราะรังสีจะทำลายแบคทีเรียและจุลินทรีย์ที่ก่อให้เกิดการเน่าเสียในอาหาร ใช้รังสีเพื่อปรับปรุงพันธุ์พืชให้มีความแข็งแรงต้านทานต่อโรคและแมลง เพื่อเพิ่มผลผลิตให้สูงขึ้น